
Химические реактивы представляют собой чистые вещества или многокомпонентные смеси с определенными экспериментальными формулами и используются в лабораторных экспериментах. Они имеют широкий спектр применения. Это химические, биомедицинские, биотехнологические и биохимические исследования, аналитическая химия: газовая и жидкостная хроматография, УФ-спектроскопия, титрование, микроскопия, скрининг и синтез.
Содержание статьи:
Реактивы необходимы во всех лабораториях: фармацевтических, химических, биологических, промышленных, научных и образовательных. При работе с ними необходимо уделять особое внимание всем аспектам, начиная с выбора квалификации и заканчивая используемыми методами и правилами хранения и утилизации. химреактивы купить вы можете в специализированном интернет-магазине ареолаб.рф.
Какие виды химических реактивов бывают
Использование реагентов в лаборатории было эффективным. Реагенты следует выбирать в соответствии с чистотой. Он определяет точность исследования и степень его использования.
В зависимости от содержания примесей реагенты имеют семь квалификаций.
- Технический (>10% примесей) для технических задач;
- Чистый (до 0,1%) для промышленных и учебных лабораторий;
- Аналитически чистый (не более 0,01%) для научных экспериментов и аналитической химии;
- Химически чистый (не более 0,000001%) для ответственных исследований;
- Спектрально чистый и особой чистоты (от 0,00005 до 10-9) для биохимического и биотехнологического анализа;
- Стандарт для специальных экспериментов (0,0000001%).
Помимо чистоты, реагенты различают по диапазонам. Все вещества можно разделить на четыре группы.
Реактивы для проведения химического синтеза.
Наиболее важным практическим применением химии является химический синтез. Это прямое получение соединений с желаемыми свойствами.
Различают органический и неорганический синтез. Органический синтез в настоящее время является наиболее известным и поэтому часто понимается под термином «синтез». В настоящее время с помощью органического синтеза получено более 10 миллионов новых органических соединений. Это материалы для новых лекарств, системы хранения и преобразования энергии, а также проектная инженерия для моделирования биотехнологических и биохимических процессов.


Органическая синтетика — это своего рода инженер для проектирования молекулярных систем. Детали» или «строительные блоки» таких систем — это синтетические реагенты.
Молекулы могут быть синтезированы различными способами, и доступность специфических реагентов играет важную роль в выборе конкретной синтетической стратегии.
Сегодня химическая промышленность производит большие количества разнообразных химических веществ для широкого спектра химических реакций, от самых простых, таких как реакции Михаэля и альдольно-кротоновой конденсации, до самых сложных, таких как катализируемые палладием реакции Сузуки и Стилла. Реакции.
Коммерческие химические реактивы, хотя и имеют довольно широкую сферу применения, должны обладать определенным набором свойств. Они должны быть стабильными при комнатной температуре и на воздухе, устойчивыми к воздействию влаги и света и невзрывоопасными.
Большинство коммерческих реагентов отвечают этим качествам. Однако в настоящее время существует также возможность длительного хранения и нестабильных реагентов, например, металлоорганических или биохимических реагентов. Хранение химических веществ более подробно рассматривается ниже.
Коммерческие реагенты также должны отличаться достаточно простой структурой, гарантирующей универсальность органического синтеза, и наличием синтетически активных функциональных групп, например, атомов галогенов или альдегидных групп.
Растворители
Как показывают химические процессы, большинство химических реакций протекает в растворе. В растворе вещества распадаются на отдельные молекулы (а иногда и ионы), поэтому реакции протекают быстрее, чем в твердых телах.
Однако следует отметить, что растворители также являются реагентами и могут вступать в побочные реакции с реагентами. Поэтому очень важно выбрать правильный растворитель для химической реакции.
С древних времен химикам известно важное правило: чем более полярный растворитель, тем больше вероятность его реакции с реагентом. Другими словами, полярные соединения (например, глюкоза) хорошо растворяются в полярных растворителях (например, воде), а неполярные соединения (например, фуллерены) — в неполярных растворителях (бензоле). В то же время, однако, поваренная соль нерастворима в гексане, а этилацетат нерастворим в воде.

Растворители могут даже влиять на процесс реакции. Например, синтетические реакции с участием металлоорганических реагентов, таких как литий- или магнийорганические производные, нельзя проводить в растворителях, которые действуют как доноры протонов (например, спиртах).
Также невозможно проводить такие реакции в растворителях, в которых молекула может содержать карбонильные или карбоксильные группы. Существует риск нуклеофильного присоединения реагентов к карбонильной группе. В качестве растворителей используйте полярный непротонический диэтиловый эфир или более безопасный тетрагидрофуран.
В органическом синтезе физические свойства растворителя могут оказывать значительное влияние на соотношение синтетических продуктов. Например, пропорции продуктов в реакции, приведенной на схеме 1 (П. Ласло, «Логика органического синтеза», 1991, том 2, стр. 26-27) — при проведении синтеза в бензоле цис- и транс-изомеры продукта составляют соответственно 6% и 59%. При проведении синтеза в диметилформамиде соотношение продуктов меняется и теперь составляет 1:1.
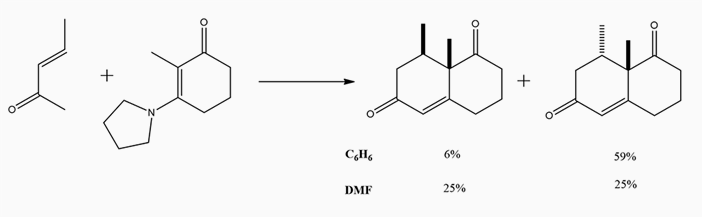
Схема 1. Различные соотношения продуктов синтеза при синтезе в различных растворителях.
Это также облегчает анализ исследовательских образцов в растворе. В настоящее время, помимо спектроскопии, одним из основных методов анализа веществ и их смесей является высокоэффективная жидкостная хроматография (ВЭЖХ).
Основная идея хроматографии заключается в разделении смесей соединений посредством межмолекулярных (ван-дер-ваальсовых) взаимодействий на границах фаз; в ВЭЖХ различают неподвижную фазу (сорбент (обычно модифицированный силикагель)) и подвижную фазу (растворитель). При проведении анализа основные характеристики вещества называются. Время удерживания» — время, за которое вещество попадает в хроматографическую систему и покидает хроматографическую колонку, заполненную сорбентом. При одинаковых условиях время удерживания одного и того же вещества постоянно. Однако выбор растворителя также играет здесь важную роль. В противном случае, вместо разделения, смесь проходит через хроматографическую колонку единым фронтом и не разделяется. Или, наоборот, они прочно застряли в колонне.
Выбор растворителя для ВЭЖХ зависит от природы сорбента (например, на обращенной фазе С18 в полярных растворителях лучше разделять смеси, тогда как на нормальной фазе SiO2 лучше использовать неполярные растворители). ), растворимость исследуемого вещества (не наносите на колонку растворы, содержащие осадки) и характер анализируемого вещества.
Другая группа растворителей — дейтерированные растворители для анализа с помощью ядерного магнитного резонанса. Поскольку изотоп водорода дейтерий не излучает сигнал в условиях экспериментов ЯМР, в синтетической химии традиционно используются растворители, в которых водород заменен дейтерием. Наиболее важными дейтерированными растворителями являются оксид дейтерия (дейтерированная вода), дейтерированный хлороформ и дейтерированный диметилсульфоксид.
Разделяющие и диагностирующие реактивы
Одной из основных практических проблем в химическом синтезе является проблема выделения продуктов реакции в чистом виде; разделение с помощью ВЭЖХ или обычной колоночной хроматографии часто является очень утомительной и трудоемкой процедурой, поэтому в синтезе часто необходимо отделить осадок от раствора Часто используются более простые методы разделения продуктов, такие как Диана.
В предыдущем разделе уже обсуждалось, как растворимость вещества в конкретном растворителе зависит от его полярности. Это также может быть использовано для выделения нужного продукта из раствора.
Одним из наиболее распространенных методов «быстрого» разделения продуктов является осаждение из концентрированных растворов путем разбавления раствора другим растворителем, в котором разделяемое вещество не растворимо (например, можно осадить соль). (из концентрированного водного раствора соли и этилового спирта).
Другим распространенным методом относительно быстрого разделения синтетических продуктов является экстракция. Это когда основной и побочный продукты разделяются с помощью двух несмешивающихся жидкостей.
Некоторые части синтеза при выделении продукта требуют нейтрализации. Например, для удаления избытка катализатора или реагентов. Например, когда синтез проводится в кислой среде, кислоту часто необходимо нейтрализовать основанием перед выделением; и наоборот, когда синтез проводится в присутствии основания, основание необходимо нейтрализовать кислотой.
При проведении синтезов, катализируемых комплексами металлов, часто необходимо обрабатывать реакционную смесь веществами, образующими прочные комплексы с переходными элементами.
Важной областью применения химии является аналитическая химия, которая занимается определением качественного и количественного состава исследуемого образца. Различают качественный анализ, при котором устанавливается, какие элементы и вещества входят в состав образца, и количественный анализ, при котором устанавливается количество веществ, входящих в состав смеси.

Существует обширная область реагентов, используемых в качественном, а не синтетическом анализе. Например, реактив Na3[Co(NO2)6], кобальт-нитрит натрия, используется для определения ионов калия в растворе. Другим примером такого реактива является реактив Несслера — щелочной раствор тетрайодортути калия K2[HgI4], используемый в качественном анализе для обнаружения ионов аммиака и аммония.
Основным методом количественного анализа является титрование, при котором раствор известной концентрации добавляется к испытуемому раствору и стехиометрическое соотношение реакции между веществами используется для определения содержания испытуемого вещества. Важным аспектом титрования является выбор индикатора — вещества, которое символизирует окончание реакции. В кислотно-основных титрованиях для этого используются такие хорошо известные вещества, как лакмус, метиловый оранжевый и фенолфталеин. При комплексном титровании основным индикатором являются вещества, образующие комплексы с ионами металлов, например, эриохром черный Т.
Вспомогательные вещества
Для облегчения реакций и быстрого измерения параметров (концентрация, pH) необходимы специальные вспомогательные реагенты. К ним относятся индикаторы, красители для микроскопа, буферы, окислители и восстановители.
Какую посуду используют для хранения и работы с реактивами
Правила работы с реактивами в лаборатории предполагают соблюдение техники и использование специального оборудования и приборов.
- Фарфоровая ступка для измельчения веществ;
- Шпатели и ложки для сыпучих реактивов;
- Мензурки, бюретки, цилиндры и пипетки для измерения жидкостей и титрования;
- Воронка и колбы для приготовления растворов;
- Вытяжные шкафы для работы с концентрированными щелочами и кислотами и летучими опасными веществами.
Правильное использование и хранение реактивов в лаборатории является требованием безопасности. При работе с ними необходимо учитывать концентрацию, опасность, состояние агломерации и химические свойства.
Для упаковки и хранения растворов неорганических кислот, щелочей, аммиака, метанола и других органических жидкостей используются стеклянные бутылки и узкогорлые бутылки с матовыми крышками. Контейнеры с широким горлышком — это контейнеры для сыпучих реагентов. Индикаторы, красители и другие вещества, используемые в небольших количествах, хранятся в пипетках.

Однако существуют некоторые реагенты, для которых хранение в стеклянной посуде недопустимо. Примерами являются фтористоводородная (плавиковая) кислота и другие производные фтора. Плавиковая кислота взаимодействует с оксидом кремния, входящим в состав стекла, что приводит к растворению материала. В будущем это приведет к разрушению стеклянной посуды.
Поэтому тефлоновая посуда используется для хранения фторированных соединений. Пластиковая посуда также используется для хранения едких щелочей и других реагентов, которые разрушают стекло, а пластиковые бутылки являются предпочтительным материалом для жидких и твердых веществ с низкой температурой плавления.
Прозрачность, цвет и герметичность контейнеров зависят от физических свойств реагентов (взаимодействие с УФ-светом, гигроскопичность и чувствительность к воздуху).
Также следует всегда следить за тем, чтобы в лаборатории не хранились соединения в непосредственной близости. Эти соединения могут вызывать бурные реакции при взаимодействии. Например, крайне нежелательно хранить щелочные металлы вблизи водных растворов, кислот и органических галогенидов.
Все вещества в лаборатории должны быть промаркированы. Если реактивы имеют специфические характеристики, они указываются в виде названия и химической формулы, квалификации и степени опасности: легковоспламеняющиеся, взрывоопасные, токсичные или должны быть защищены от воды.
Лабораторные материалы должны быть учтены. Это относится не только к опасным и токсичным материалам, таким как цианистый калий, мышьяк и ртуть, но и к безопасным. Такой подход позволяет отслеживать сроки годности и остатки, контролировать выдачу и формировать заказы на поставку.
Правила утилизации сухих и жидких реактивов
Утилизация реактивов в лаборатории возможна только после того, как они будут нейтрализованы или сделаны безвредными с помощью небольшого количества определенного стока.
Опасные вещества — токсичные, ядовитые, легковоспламеняющиеся и высококонцентрированные едкие щелочи и кислоты не должны сбрасываться в общественную канализацию. Они должны быть утилизированы в установленном законом порядке.




